Давление газа, заключенного в постоянный объем, не является пропорциональным температуре, отсчитанной по шкале Цельсия. Это ясно, например, из таблицы, приведенной в предыдущем параграфе… Если при
![]() давление газа равно 1, 37 атм, то при
давление газа равно 1, 37 атм, то при
![]() оно равно 1,73 атм. Температура, отсчитанная по шкале Цельсия, увеличилась вдвое, а давление газа увеличилось только в 1,26 раза. Ничего удивительного в этом нет, ибо шкала Цельсия установлена условно, без всякой связи с законами расширения газа. Можно, однако, пользуясь газовыми законами, установить такую шкалу температур, что давление газа будет пропорционально температуре, измеренной по этой шкале.
оно равно 1,73 атм. Температура, отсчитанная по шкале Цельсия, увеличилась вдвое, а давление газа увеличилось только в 1,26 раза. Ничего удивительного в этом нет, ибо шкала Цельсия установлена условно, без всякой связи с законами расширения газа. Можно, однако, пользуясь газовыми законами, установить такую шкалу температур, что давление газа будет пропорционально температуре, измеренной по этой шкале.
В самом деле, пусть при некоторой температуре
![]() давление газа равно
давление газа равно
![]() а при некоторой другой температуре
а при некоторой другой температуре
![]() давление газа равно
давление газа равно
![]() . По закону Шарля
. По закону Шарля
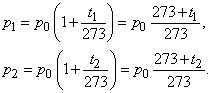
Разделив эти равенства почленно, получим
![]() . (234.1)
. (234.1)
Величину
![]() можно рассматривать как значение температуры, отсчитанное по новой температурной шкале, единица которой такая же, как и у шкалы Цельсия, а за нуль принята точка, лежащая на
можно рассматривать как значение температуры, отсчитанное по новой температурной шкале, единица которой такая же, как и у шкалы Цельсия, а за нуль принята точка, лежащая на
![]() ниже точки, принятой за нуль шкалы Цельсия, т. е. точки таяния льда. Нуль этой новой шкалы называют абсолютным нулем. Это название обусловлено тем, что, как было доказано английским физиком Вильямом Томсоном Кельвином (1824—1907), ни одно тело не может быть охлаждено ниже этой температуры. Эту новую шкалу называют термодинамической шкалой температур. Таким образом, абсолютный нуль указывает температуру, равную
ниже точки, принятой за нуль шкалы Цельсия, т. е. точки таяния льда. Нуль этой новой шкалы называют абсолютным нулем. Это название обусловлено тем, что, как было доказано английским физиком Вильямом Томсоном Кельвином (1824—1907), ни одно тело не может быть охлаждено ниже этой температуры. Эту новую шкалу называют термодинамической шкалой температур. Таким образом, абсолютный нуль указывает температуру, равную
![]() , и представляет собой температуру, ниже которой не может быть ни при каких условиях охлаждено ни одно тело.
, и представляет собой температуру, ниже которой не может быть ни при каких условиях охлаждено ни одно тело.
Температура
![]() представляет собой термодинамическую температуру тела, имеющего по шкале Цельсия температуру, равную
представляет собой термодинамическую температуру тела, имеющего по шкале Цельсия температуру, равную
![]() . Обычно термодинамическую температуру обозначают буквой
. Обычно термодинамическую температуру обозначают буквой
![]() . Единица термодинамической шкалы температур носит название кельвин
. Единица термодинамической шкалы температур носит название кельвин
![]() и является одной из основных единиц СИ. Кельвин совпадает с градусом Цельсия.
и является одной из основных единиц СИ. Кельвин совпадает с градусом Цельсия.
Между температурой
![]() , отсчитанной по шкале Цельсия, и термодинамической температурой
, отсчитанной по шкале Цельсия, и термодинамической температурой
![]() имеются следующие соотношения:
имеются следующие соотношения:
![]() или
или
![]() .
.
Из сказанного вытекает, что равенство (234.1) можно представить в виде
![]() (234.2)
(234.2)
— давление данной массы газа при постоянном объеме пропорционально термодинамической температуре. Это — другое выражение закона Шарля.
Формулой (234.2) удобно пользоваться и в том случае, когда давление при
![]() неизвестно. Рассмотрим пример. Пусть при
неизвестно. Рассмотрим пример. Пусть при
![]() давление газа в баллоне
давление газа в баллоне
![]() . Каково давление при температуре
. Каково давление при температуре
![]() ? В данном случае термодинамические температуры газа равны соответственно
? В данном случае термодинамические температуры газа равны соответственно
![]() .
.
Пользуясь законом Шарля, можем написать
![]() , откуда
, откуда
![]()
234.1.
Манометр на баллоне с кислородом в помещении с температурой воздуха, равной
![]() , показывал давление 95 атм. Этот баллон вынесли в сарай, где на другой день при температуре
, показывал давление 95 атм. Этот баллон вынесли в сарай, где на другой день при температуре
![]() показание манометра было 85 атм. Возникло подозрение, что часть кислорода из баллона была израсходована. Проверьте, правильно ли это подозрение.
показание манометра было 85 атм. Возникло подозрение, что часть кислорода из баллона была израсходована. Проверьте, правильно ли это подозрение.











Комментарии: (0)