Уравнение Теплового Баланса. Первый Закон Термодинамики
Если тела образуют замкнутую систему и между ними происходит только теплообмен, то алгебраическая сумма полученных Qnи отданных Q0энергий равна нулю:Полученная Qn и отданная Q0 теплоты численно равны, но Qn берется со знаком плюс, a Q0 - со знаком минус.
Итак, изменить внутреннюю энергию системы можно двумя способами: путем совершения работы (дельта U1 = A) и путем сообщения системе количества теплоты (дельта U2 = Q).
Первый закон термодинамики
Первый закон термодинамики - закон сохранения энергии для систем, в которых существенную роль играют тепловые процессы:
Теплота Q, подведенная к системе, затрачивается на изменение дельта U ее внутренней энергии и на совершение работы А` системой над внешними телами:
Работа и теплопередача - характеристики процесса изменения внутренней энергии системы; они определяют функции процесса, но не состояния системы. В каждом состоянии система обладает вполне определенной внутренней энергией.
Применение первого закона термодинамики к процессам в одноатомных идеальных газах
-
Изотермический процесс (Т = const):
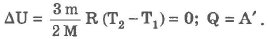
При изотермическом процессе обмен энергией между идеальным газом и окружающими телами происходит и в форме теплопередачи, и в форме работы. Все подведенное к идеальному газу тепло затрачивается на совершение работы.
Если газ получает теплоту (Q > 0), то он совершает положительную работу (А` > 0), если газ отдает теплоту (Q < 0), то А` < 0. Работа внешних сил над газом в этом случае положительная (А > 0).
-
Изобарический процесс (р = const):
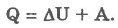
При изобарическом процессе обмен энергией между идеальным газом и окружающими телами происходит в форме работы и теплопередачи. Сообщенная идеальному газу теплота затрачивается и на изменение внутренней энергии, и на совершение газом работы:
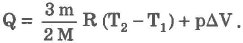
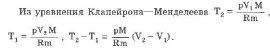
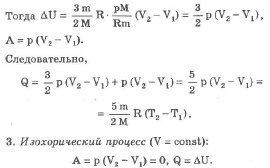
-
Изохорический процесс:
При изохорическом процессе обмен между идеальным газом и окружающими телами происходит только в форме теплопередачи. Вся подведенная к идеальному газу теплота затрачивается на изменение его внутренней энергии:
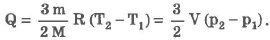
-
Адиабатический процесс (Q = 0):
Адиабатический процесс - процесс, при котором физическая система не получает теплоты извне и не отдает ее. Этот процесс протекает без теплообмена с окружающими телами.
При адиабатическом процессе:
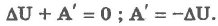
При адиабатическом процессе обмен энергией между идеальным газом и окружающими телами происходит только в форме работы. Работа при адиабатическом процессе совершается за счет изменения внутренней энергии газа.
Если А` > 0 (газ расширяется), то дельта U < 0 - температура газа понижается. Если же А` < 0 (газ сжимается), то дельта U > О - температура повышается.













наверное, это потому что тут про тепловой