Строение атома определяет его агрегатное состояние?
Строение атома определяет его агрегатное состояние? Почему углерод твёрдый, а азот, кислород газ?
То, что агрегатное состояние определяется температурой и давлением очевидно, но главное — это строение атомов.
При одной и той же «температуре и давлении» углерод является твёрдым, а азот, кислород газом. Почему? Потому что строение атомов различное. А конкретнее? Никто не знает..
отредактировал(а) Пиотровский : 2021-06-02 11:43 GMT

Может быть строение молекул?
#42599 Борисов Виктор :Может быть строение молекул?
И молекул, естественно, тоже. Почему, при одной и той же температуре, давлении (комнатной 20°C), вода H2O -жидкость, а кислород, водород -газы?
Но строение молекул определяется строением, входящих атомов.

Агрега́тные состояния вещества, состояния одного и того же вещества (например, воды, железа, серы), переходы между которыми сопровождаются скачкообразными изменениями свободной энергии (См. Свободная энергия), энтропии (См. Энтропия), плотности (См. Плотность) и других основных физических свойств. Так, вода при нормальном давлении 101 325н/м2 = 760 мм рт. ст. и при 0°С кристаллизуется в лёд, а при 100°С кипит и превращается в пар. Следовательно, вода может существовать в твёрдом, жидком и газообразном А. с. К трём указанным А. с. вещества часто причисляют ещё плазму (См. Плазма). Существование нескольких А. с. обусловлено различиями в характере теплового движения молекул (атомов) вещества и в их взаимодействии. В газах (См. Газы) молекулы почти не взаимодействуют и движутся свободно, заполняя весь объём, в котором газ находится. У жидкостей (См. Жидкость) и твёрдых тел (См. Твёрдое тело) — конденсированных систем — молекулы (атомы) расположены близко друг от друга и взаимодействуют со значительными силами. Это приводит к сохранению жидкостями и твёрдыми телами определённого объёма. Однако характер движения молекул в жидкостях и в твёрдых телах различен, чем и объясняется различие их структуры и свойств. У твёрдых тел в кристаллическом состоянии атомы совершают лишь небольшие колебания вблизи узлов кристаллической решётки; структура этих тел характеризуется высокой степенью упорядоченности — дальним порядком в расположении атомов (см. Дальний порядок и ближний порядок). Тепловое движение молекул жидкости представляет собой сочетание малых колебаний около положений равновесия и частых перескоков из одного положения равновесия в другое. Последние и обусловливают существование в жидкостях лишь ближнего порядка в расположении молекул (атомов), а также свойственные жидкому состоянию подвижность и текучесть.
Плазму выделяют в особое А. с. вещества в связи с тем, что заряженные частицы плазмы, в отличие от нейтральных молекул обычного газа, взаимодействуют друг с другом на больших расстояниях. Этим объясняется ряд своеобразных свойств плазмы.
Источник: https://gufo.me/dict/bse/%D0%90%D0%B3%D1%80%D0%B5%D0%B3%D0%B0%D1%82%D0%BD%D1%8B%D0%B5_%D1%81%D0%BE%D1%81%D1%82%D0%BE%D1%8F%D0%BD%D0%B8%D1%8F
Агрегатное состояние вещества определяется макроскопическими параметрами температурой, давлением, напряженность электростатического поля и объемом. T, P, E, V.
Влияние напряженности слабо изучено. Но приложения 10 В разности потенциалов к веществу равносильно пвышению температуы на 1 °С.
Что логично так как 1В = 1Дж/1Кл. Напоминаю 1 В — это разность потенциалов между двумя такими точками электростатического поля, при перемещении между которыми заряда в 1 Кл силами поля совершается работа 1 Дж. А Джоули это мера энергии. Срению величину будем обозначать как принято в современных учебниках бра и кет скобками \(<x>\)
\(U=\frac{E}{q}=\frac{N <E_{el}>}{q}\)
\(<E_{FF}>=\frac{3}{2}kT=<E_{el}>+(<E_{str}>+<E_{bond}>+<E_{tors}>+<E_{vdw}>+<E_{cross}>+...)\)

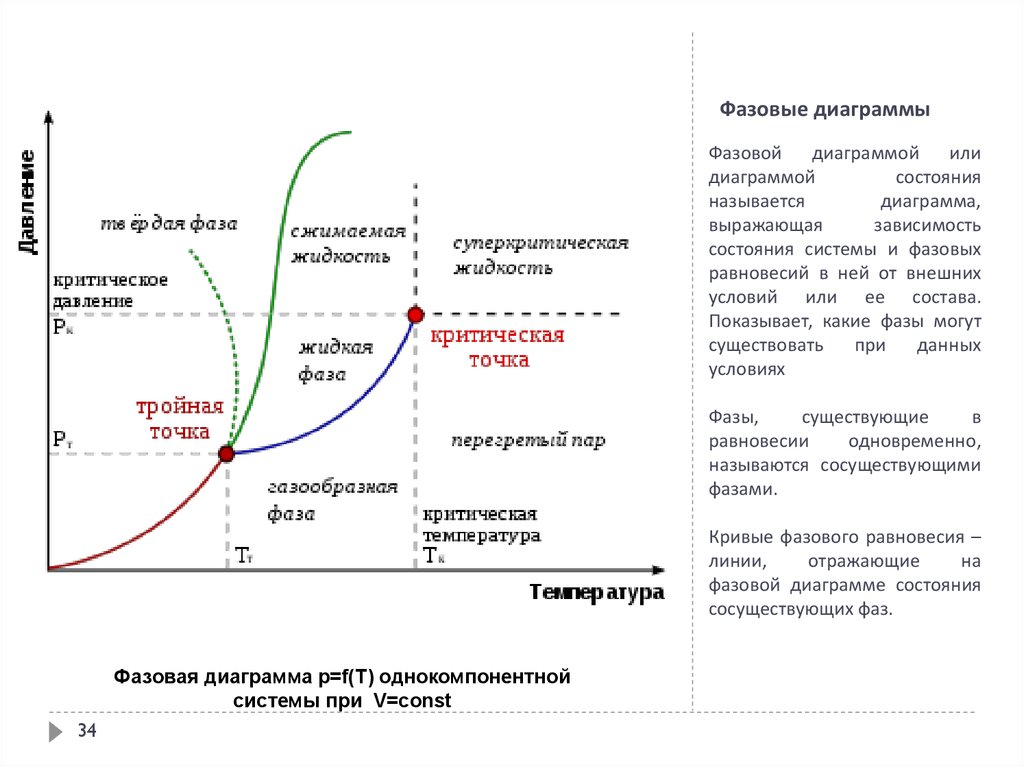
Так вот структура атома определяет критические точки на фазовой диаграмме. И не только их но и то будут ли смачиваться вещества. Или же они как масло по линолиуму будут загибаться и скользить одно по другому. Хотя тут более интересно эффект истерания. Структура атомов определяет бует ли вещество А скользить по веществу Б или же оно будет задирать. К примеру почему стальной нож не оставляет значемых зарапин на стеклянной бутылке, а алмаз спокойно его царапает. Или почему пластековые трубы сохроняют свой размер, а железные по степенно истераютс водой и утоньшаются.
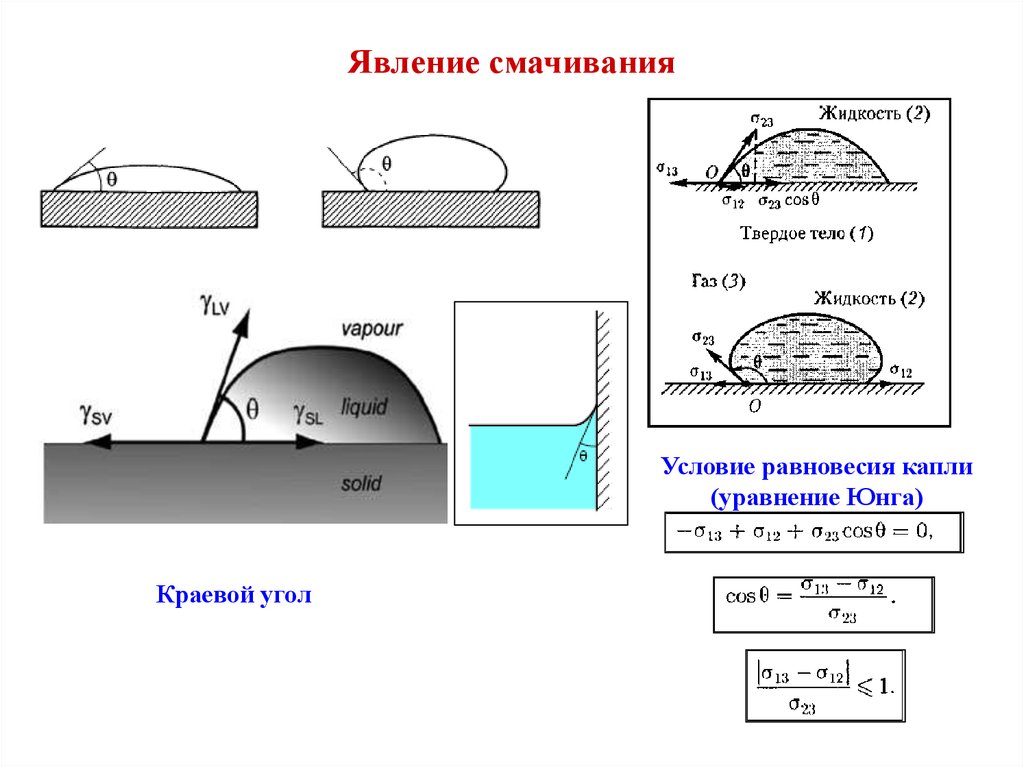
Но давай пробежимся с самого начала со структуры атома и химии атомов и молекул.

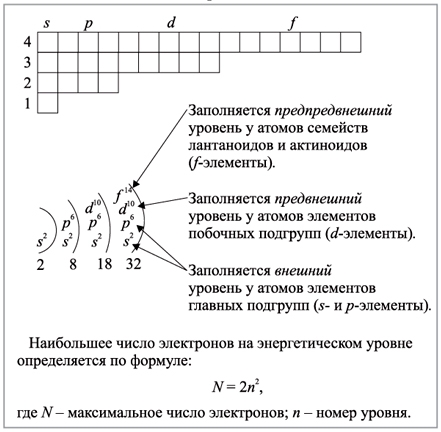
Структура атома определяетя 3 основными правилами:
Принцип Паули 1925 год
Правило Клечковского 1951 год (Маделунг 1936 год)
Правило Хунда 1925 год.
Источник
https://chemege.ru/kvantovye-chisla/
Принцип (запрет) Паули
В атоме не может быть двух электронов со всеми четырьмя одинаковыми квантовыми числами. Принцип Паули определяет максимальное число электронов Nn, на электронном слое с номером n:
N n = 2n2. (2)
На первом электронном слое может находиться не более двух электронов, на втором – 8, на третьем – 18 и т. д.
Правило Хунда
Заполнение энергетических уровней происходит таким образом, чтобы суммарный спин был максимальным. Например, три р-электрона на орбиталях р-оболочки располагаются следующим образом:

Таким образом, каждый электрон занимает одну р-орбиталь.
Правило Клечковского (также Правило n + l; также используется названия правило Маделунга или принцип Ауфбау) — эмпирическое правило, описывающее энергетическое распределение орбиталей в многоэлектронных атомах.
Правило Клечковского гласит: Заполнение электронами орбиталей в атоме происходит в порядке возрастания суммы главного и орбитального квантовых чисел
. При одинаковой сумме раньше заполняется орбиталь с меньшим значением
.
Приведённую в таблице очерёдность заполнения электронами атомных орбиталей удобно представить в виде схемы:
Исключения из правила Клечковского
Эмпирическое правило Клечковского и вытекающее из него схема очерёдностей несколько противоречат реальной энергетической последовательности атомных орбиталей только в двух однотипных случаях, а именно: у атомов Cr, Cu, Nb, Mo, Ru, Rh, Pd, Ag, Pt, Au[1] имеет место «провал» электрона с s-подуровня внешнего слоя на d-подуровень предыдущего слоя, что приводит к энергетически более устойчивому состоянию атома; после заполнения двумя электронами орбитали 6s следующий электрон появляется на орбитали 5d, а не 4f, и только затем происходит заселение четырнадцатью электронами орбиталей 4f, затем продолжается и завершается заселение десятиэлектронного состояния 5d. Аналогичная ситуация характерна и для орбиталей 7s, 6d и 5f.
Так вот эти импирические правила определяют структуру. Теперь по говорим о атомах. Атомы обладают химическими связями и в засимости от заселенности электронами посленего уровня они могут по жиниться с другими атомами. Зацепившись электронами. Сцепка атомов происходит по правилу Паули когда на свободные места электроны занимают свободные места в клетках у соседнего электрона.
Поэтому все атомы делятся по количеству связий на 2,3,4,5,6 валентные.
Газ состоит из 2-х атомных молекул у них по две сцепки по 2 свободных места для электронво которыми они могут удержаться друг за друга. Так как других связий у них нет, то такие молекулы легко улетают от молейшего толчка.
В кристалах атомы имеют по 3 соседа, а в пластике и силикони по 4-6 и им уже труднее улететь так как нужно поднять большую массу нужна большая энергия. Это косается испарения.
Но мы уже видим как строение атома определяет агрегатное состояние. Но еще не доконца это осознаем. Будем разбираться дальше.
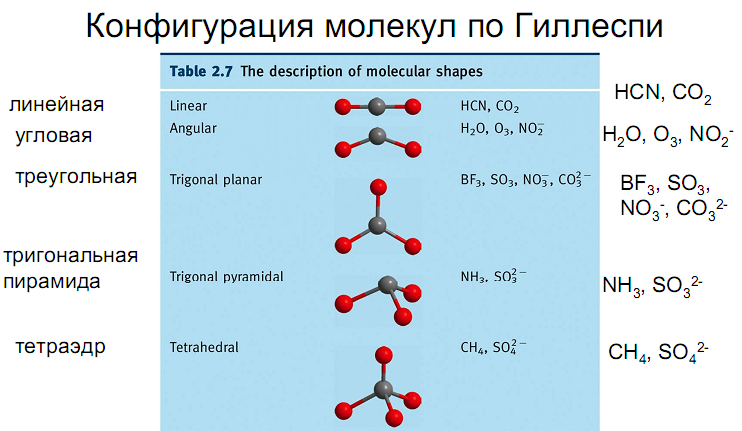
Теперь поговорим о воде как так получается что молекула воды угловая, но не улитает как линейная молекула газа CO2.
У воды есть Ван Дер Вальсова связь по мимо 2-х ручек у ней есть еще по 2 дополнительные. Но они более слабые. Такая сила в 10 раз слобее химической связи. Но при комнотной температуре её хватает что бы удержать молекулы воды в месте.
Выпишем все силы которые есть в молекуле вс они определяются структурой атома.
Так как в атоме есть заряды то там есть сила Кулона. Когда нуклоны атома подходят близко проявляются Ван Дер Вальсовы силы описываемые уравнением потениала Леннарда-Джонса, но так же у нуклонов есть сила инерции.
Эти две силы порождают энергию колебатильного движения, вращательного движения(сгибательного и торсионного) и энергию Ван Дер Вальсовы далее, что бы не путать \(E_{VDW}\).
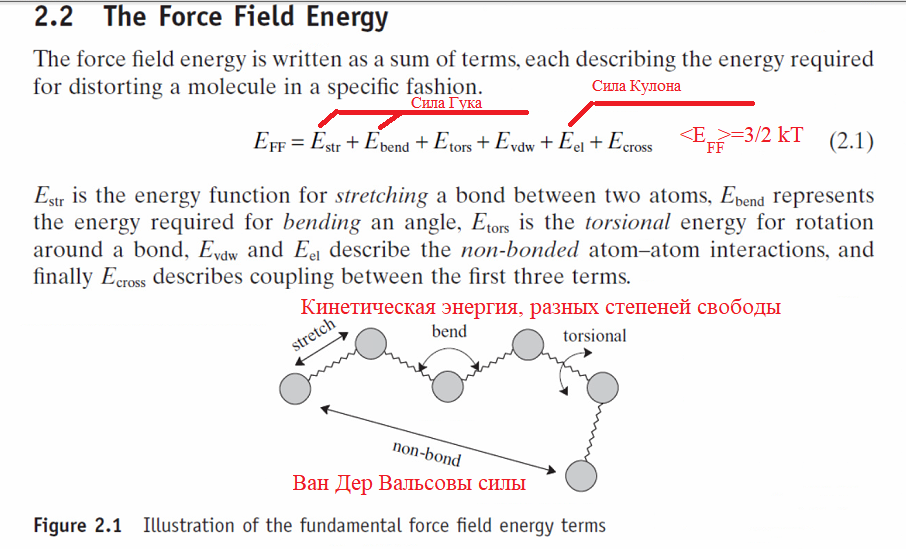

\(\sigma\) — это размер нуклона или атома Последний зависит от порядкового номера.
 .
.
https://doi.org/10.1063/1.1712084
Примечание потенциал Леннарда-Джонса хорошо работает не только с молекулами газа, но и для нуклонов. Структура атома это преде всего нуклоны электроны и протоны.
Пока они далеко у нас действует сила Кулона к примеру в плазме, как только они сблизились действует сила Леннарда-Джонса
Coulomb это товарищь Кулон вот так вот исказилась его фамилия.
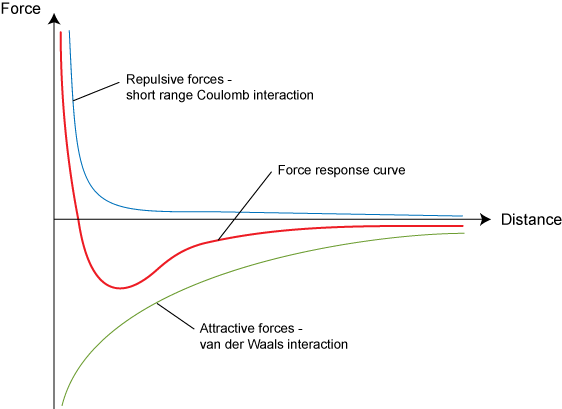
Мы уже видим и знаем что структура атома определяет силы с которыми притягиваются разные части молекулы. Остается только перевести параметры ядер в макропараметры давление и температуры. И мы сможем получить константы Ван-дер-Вальса.
источник:
https://ru.wikipedia.org/wiki/Уравнение_Ван-дер-Ваальса
Хотя модель идеального газа хорошо описывает поведение реальных газов при низких давлениях и высоких температурах, в других условиях её соответствие с опытом гораздо хуже. В частности, это проявляется в том, что реальные газы могут быть переведены в жидкое и даже в твёрдое состояние, а идеальные — не могут.
Для более точного описания поведения реальных газов при низких температурах была создана модель газа Ван-дер-Ваальса, учитывающая силы межмолекулярного взаимодействия. В этой модели внутренняя энергия
становится функцией не только температуры, но и объёма.
Уравнение Ван-дер-Ваальса — это одно из широко известных приближённых уравнений состояния, описывающее свойства реального газа, имеющее компактную форму и учитывающее основные характеристики газа с межмолекулярным взаимодействием[7].
Уравнение состояния
Изотермы газа ван дер Ваальса:
P — давление;
V — объём;
K — критическая точка;
abKcd — бинодаль (граница области двухфазного равновесия; область под колоколом бинодали — область двухфазного равновесия жидкость — пар);
eKf — спинодаль (граница между областями метастабильных и термодинамически неустойчивых состояний; область под колоколом спинодали — нереализуемые состояния);
bc — коннода (линия конденсации);
abKe — область перегретой жидкости;
dcKf — область переохлаждённого пара;
площади закрашенных фигур под изобарой bc и над ней равны (правило Максвелла, 1875)Термическим уравнением состояния (или, часто, просто уравнением состояния) называется связь между давлением, объёмом и температурой.
Для одного моля газа Ван-дер-Ваальса оно имеет вид:

где
— давление,
— молярный объём,
— абсолютная температура,
— универсальная газовая постоянная.
Видно, что это уравнение фактически является уравнением состояния идеального газа с двумя поправками. Поправка a {\displaystyle a}
учитывает силы притяжения между молекулами (давление на стенку уменьшается, так как есть силы, втягивающие молекулы приграничного слоя внутрь), поправка b {\displaystyle b}
— суммарный объём молекул газа.
Для
молей газа Ван-дер-Ваальса уравнение состояния выглядит так:

где
— объём.
Из рисунка, на котором изображены изотермы газа Ван-дер-Ваальса, видно, что ниже некоторой температуры зависимость
перестаёт быть монотонной: образуется петля Ван-дер-Ваальса, в которой увеличению давления соответствует увеличение объёма, что противоречит законам термодинамики. Появление петли означает, что уравнение Ван-дер-Ваальса в данной области изменения
и
перестаёт описывать действительную ситуацию, когда имеет место фазовый переход газ — жидкость и реальная изотерма представляет собой отрезок прямой — конноду (ноду), соединяющу

Критические параметры агрегатного состояния вещества.
Критическими параметрами газа называются значения его макропараметров (давления, объёма и температуры) в критической точке, то есть в таком состоянии, когда жидкая и газообразная фазы вещества неразличимы. Найдём эти параметры для газа Ван-дер-Ваальса, для чего преобразуем уравнение состояния:


Мы получили уравнение третьей степени относительно


В критической точке все три корня уравнения сливаются в один, поэтому предыдущее уравнение эквивалентно следующему:


Приравняв коэффициенты при соответствующих степенях
, получим равенства:

}

Из них вычислим значения критических параметров…



…и критического коэффициента:

Источник: https://gufo.me/dict/bse/%D0%90%D0%B3%D1%80%D0%B5%D0%B3%D0%B0%D1%82%D0%BD%D1%8B%D0%B5_%D1%81%D0%BE%D1%81%D1%82%D0%BE%D1%8F%D0%BD%D0%B8%D1%8F
Источник: https://gufo.me/dict/bse/%D0%90%D0%B3%D1%80%D0%B5%D0%B3%D0%B0%D1%82%D0%BD%D1%8B%D0%B5_%D1%81%D0%BE%D1%81%D1%82%D0%BE%D1%8F%D0%BD%D0%B8%D1%8F
Источник: https://gufo.me/dict/bse/%D0%90%D0%B3%D1%80%D0%B5%D0%B3%D0%B0%D1%82%D0%BD%D1%8B%D0%B5_%D1%81%D0%BE%D1%81%D1%82%D0%BE%D1%8F%D0%BD%D0%B8%D1%8F
отредактировал(а) Очепятка: 2021-06-02 23:42 GMT
#42611 Очепятка :
Но давай пробежимся с самого начала со структуры атома и химии атомов и молекул.

Атом — не частица, а СЛОВО, обозначающее неразрывную совокупрость электрона, нейтрона и протона.
«Целкни кобылу в нос — она взмахнет хвостом.»
«Зри в корень» К.Прутков С
Я умею читать мысли других, но только тогда, когда они у них есть

Атом — не частица, а СЛОВО, обозначающее неразрывную совокупрость электрона, нейтрона и протона.
В опытах Резерфорда и Жан Пере электрон отрывался от атома.
Потенциалом ионизации называется энергия, необходимая для отрыва электрона от атома или иона. Справочные данные можно найти в книге
Никольский Б.П. (ред.) — Справочник химика. т.1-Химия (1966) стр 325
Их измеряют на таких вот установках как масспектографы.

Принципиальная схема измерения

https://en.wikipedia.org/wiki/Mass_spectrometry
Эта энергия входит в формулу Ленарда-джонана как энергия потенциальной ямы. Вернее для рачетов берут среднее от двух веществ.
\(\sigma^{AB}=\sigma^A+\sigma^B\)
\(\epsilon^{AB}=\sqrt{\epsilon^{A}\epsilon^{B}}\)
Introduction to Computational Chemistry стр 59 формула (2.18)
отредактировал(а) Очепятка: 2021-06-07 21:26 GMT
#42664 Очепятка :Атом — не частица, а СЛОВО, обозначающее неразрывную совокупрость электрона, нейтрона и протона.
В опытах Резерфорда и Жан Пере электрон отрываля от атома.
А куда девали оставшиеся протон и нейтрон?
«Целкни кобылу в нос — она взмахнет хвостом.»
«Зри в корень» К.Прутков С
Я умею читать мысли других, но только тогда, когда они у них есть

Ну как куда? Почитайте книжки там всё расписано. Резерфорд наблюдал 3 типа лучей Альфу, Бету, Гамму
Жан Паре наблюдал разрушение катода.
Вы же можете взять CD диск оставить его на солнце и увидеть как он изменит цвет, подгорит. Или сходить к зубному поставить пломбу.
Как еще вариант взять солнечный элемент.
Если ядро не развалится, а при ионизации это довольно редкое явление то протон останется в ядре.
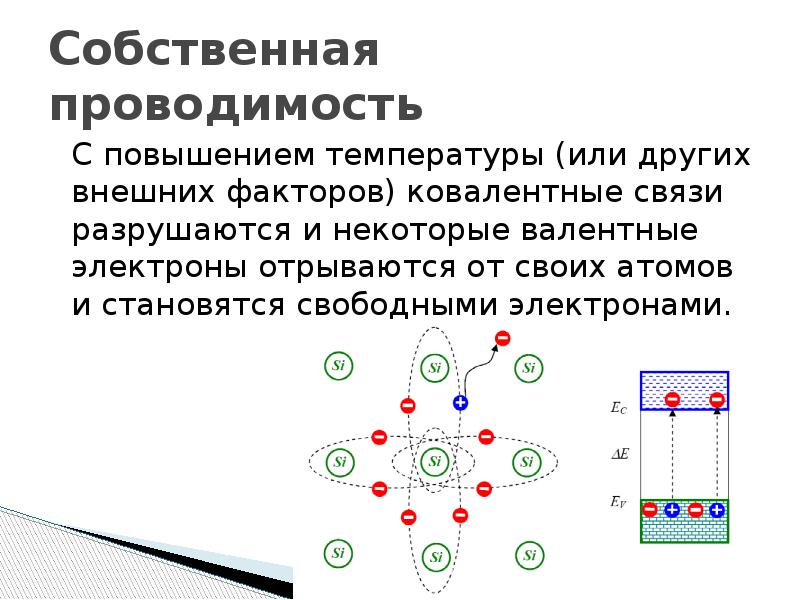
Если атом был в кристалле, то его ядро так в нем и останется. На месте оторвавшегося электрона останется валентная зона известная как дырка полупроводника. В полимерах у нас будет перестройка химических связей. Ионы состоящие из протонов начнут захватывать соседние электроны не ионизированных атомов. Так, к примеру, отвердевают эфирные смолы когда мономеры превращаются в полимеры в эпоксидной смоле.
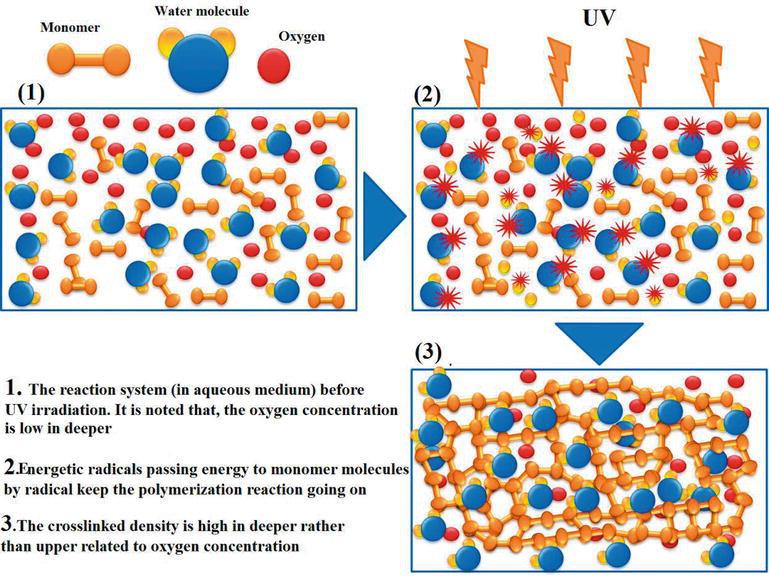
В газах протоны сидящие в ядре просто полетят проч от электрона. Пока не встретят пару на катоде с которой моет пожениться т.е. обменяться электронами и освободить её из плена поля кристаллических сил вырвав несвободу. В опытах с газоразрядной трубке таких как у Жанна Пере разрушался катод.
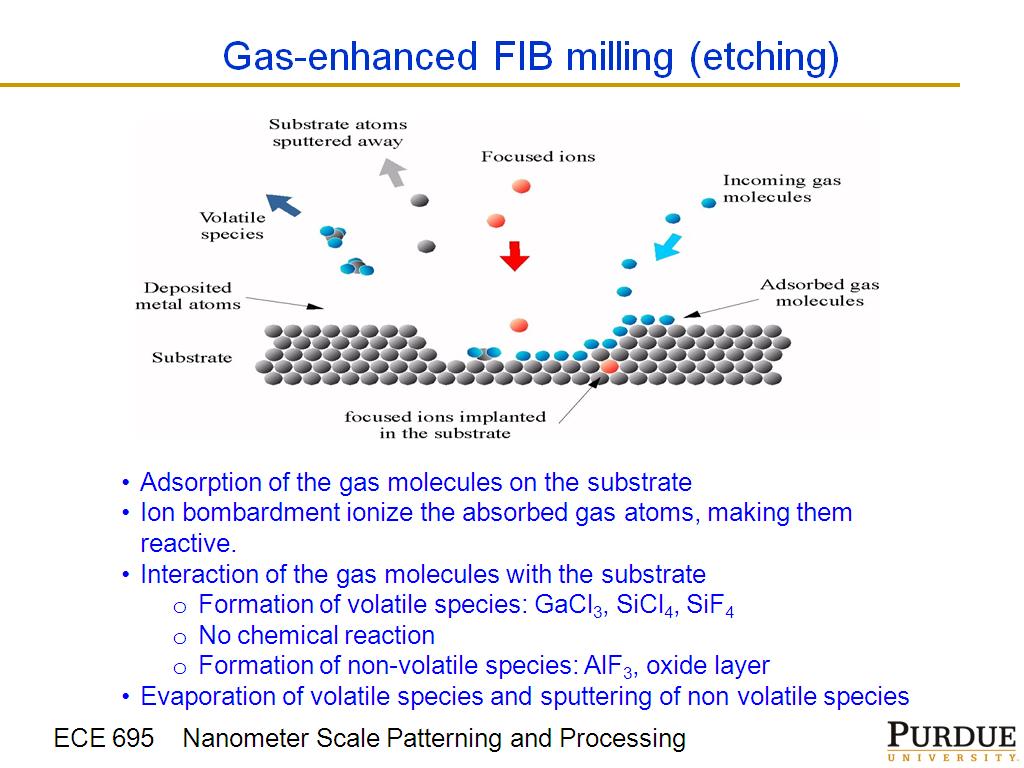

Если энергии ионизации хватит, то помимо оторванных электронов мы будем наблюдать разрушение атома и освобождение протонов и альфа-частиц(2 протона и 2 нейтрона) – и те и те положительные частицы наблюдал Резерфорд как альфа лучи. А масспектрографа у него не было, поэтому отличить протоны от альфа частиц он не мог. Такая жирная альфа хорошо видная в камере Вильсона и худая Бета
Что касается нейтронов, то их открыли уже после опытов Резерфорда.
отредактировал(а) Очепятка: 2021-06-07 23:24 GMT
#42679 Очепятка :Если энергии ионизации хватит, то помимо оторванных электронов мы будем наблюдать разрушение атома и освобождение протонов и альфа-частиц(2 протона и 2 нейтрона) –
На самом деле наблюдается выход энергии. Разрушить атом НЕВОЗМОЖНО т.к. это только слово.
На самом деле НИКТО не исследовал, что случилось с исходным материалом — вс были заворожены черточками на фотографической пластине, оставленные непонятно чем.
«Целкни кобылу в нос — она взмахнет хвостом.»
«Зри в корень» К.Прутков С
Я умею читать мысли других, но только тогда, когда они у них есть






