Одной из важных постоянных атомной физики является постоянная Авогадро (см. том I, § 242) — число структурных элементов (атомов, молекул, ионов и т. п.) в моле вещества. Зная постоянную Авогадро, можно найти величины, характеризующие отдельный атом: массу и размеры атома, заряд иона и т. п.
Существует ряд способов измерения постоянной Авогадро. В них используются физические явления различного рода. К числу таких явлений относятся броуновское движение частиц, взвешенных в жидкости или газе (см. том I, §219), радиоактивность (см. гл. XXII), рассеяние света в газах и др. Наиболее точным методом определения этой постоянной является метод, основанный на дифракции рентгеновского излучения.
Из оптики (см. гл. XVII) мы знаем, что рентгеновское излучение представляет собой электромагнитные волны, отличающиеся от видимого света значительно меньшей длиной волны. Волновая природа рентгеновского излучения была установлена впервые в опытах по дифракции на кристаллах. Эти опыты одновременно подтвердили справедливость представления о кристаллах как о совокупности правильно расположенных атомов, образующих пространственную решетку (см. том I, §266).
Пучок рентгеновских лучей, падающих на кристалл, рассеивается по преимуществу в некоторых избранных направлениях (см. § 154). Углы рассеяния определяются длиной волны рентгеновского излучения и расстоянием между соседними атомами в кристалле. Если одна из этих величин известна, то, измерив углы рассеяния, можно определить вторую.
Длину волны рентгеновского излучения измеряют с большой точностью по дифракции на обыкновенной штриховой решетке, подобной решеткам, применяемыми оптике (см. §§ 135 и 138). Зная же длину волны рентгеновского излучения, мы можем определить межатомное расстояние в кристалле. В кристаллах типа каменной соли
![]() атомы расположены по вершинам куба со стороной, равной кратчайшему межатомному расстоянию
атомы расположены по вершинам куба со стороной, равной кратчайшему межатомному расстоянию
![]() . Объем кристалла, приходящийся на один атом, составляет
. Объем кристалла, приходящийся на один атом, составляет
![]() , на одну молекулу
, на одну молекулу
![]() . Пусть объем кристаллического вещества, количество которого равно 1 молю, есть
. Пусть объем кристаллического вещества, количество которого равно 1 молю, есть
![]() . Тогда постоянную Авогадро можно найти по формуле
. Тогда постоянную Авогадро можно найти по формуле
![]()
Все разнообразные способы измерения постоянной Авогадро приводят к одному и тому же значению. По современным измерениям значение это равно
![]()
Согласие различных способов определения постоянной Авогадро (равно как и согласие различных способов измерения масс, размеров и скоростей атомов) является убедительным доказательством справедливости атомистической теории вещества.
Обратим внимание на резкое различие сжимаемости газов, с одной стороны, и жидкостей и твердых тел, с другой стороны.
Согласно закону Бойля — Мариотта (см. том I, §226) для уменьшения объема газа на
![]() достаточно на
достаточно на
![]() увеличить давление. В твердых же телах и жидкостях уменьшение объема на
увеличить давление. В твердых же телах и жидкостях уменьшение объема на
![]() требует увеличения давления в десятки и сотни раз (исходное давление предполагается атмосферным). Это различие объясняется тем, что молекулы газов находятся на расстояниях, которые во много раз превосходят размеры молекул. Их сближению препятствует тепловое движение. Силы же взаимодействия между молекулами газа, находящимися на больших расстояниях друг от друга, настолько слабы, что их можно не учитывать. Наоборот, в жидкостях и в твердых телах атомы (или молекулы) можно рассматривать как расположенные почти «вплотную». При сближении атомов (молекул) возникают огромные силы отталкивания, которые и затрудняют уменьшение объема этих тел.
требует увеличения давления в десятки и сотни раз (исходное давление предполагается атмосферным). Это различие объясняется тем, что молекулы газов находятся на расстояниях, которые во много раз превосходят размеры молекул. Их сближению препятствует тепловое движение. Силы же взаимодействия между молекулами газа, находящимися на больших расстояниях друг от друга, настолько слабы, что их можно не учитывать. Наоборот, в жидкостях и в твердых телах атомы (или молекулы) можно рассматривать как расположенные почти «вплотную». При сближении атомов (молекул) возникают огромные силы отталкивания, которые и затрудняют уменьшение объема этих тел.
Таким образом, среднее расстояние между центрами соседних атомов твердого или жидкого тела можно приближенно считать линейным размером атома. Зная постоянную Авогадро, легко вычислить это расстояние.
Моль вещества содержит
![]() атомов и занимает объем
атомов и занимает объем
![]() , где
, где
![]() — плотность вещества,
— плотность вещества,
![]() — его молярная масса. Придадим молю вещества форму куба. На ребре куба уложится
— его молярная масса. Придадим молю вещества форму куба. На ребре куба уложится
![]() атомов; длина ребра будет равна корню кубическому из объема куба, т. е.
атомов; длина ребра будет равна корню кубическому из объема куба, т. е.
![]() . Поделив длину ребра на число атомов на нем, получим среднее расстояние между центрами соседних атомов, которое мы принимаем за приближенный размер атома. Это расстояние
. Поделив длину ребра на число атомов на нем, получим среднее расстояние между центрами соседних атомов, которое мы принимаем за приближенный размер атома. Это расстояние
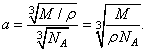
Для жидкого водорода (при температуре
![]() ), подставляя
), подставляя
![]() и
и
![]() , находим
, находим
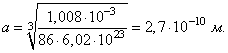
Для других элементов расчет дает сходные значения. Мы можем заключить, что линейные размеры всех атомов близки к
![]() .
.
Зная постоянную Авогадро, можно также определить массу атома:
![]() .
.
Эта формула дает нам среднее значение массы атома. Вопрос о том, одинаковы ли все атомы данного элемента по массе или нет, должен быть решен опытом (см. § 195).
Легчайшим из атомов является атом водорода, относительная атомная масса которого равна
![]() и, следовательно,
и, следовательно,
![]() . Разделив это значение
. Разделив это значение
![]() на
на
![]() получим массу атома водорода:
получим массу атома водорода:
![]()














Комментарии: (0)